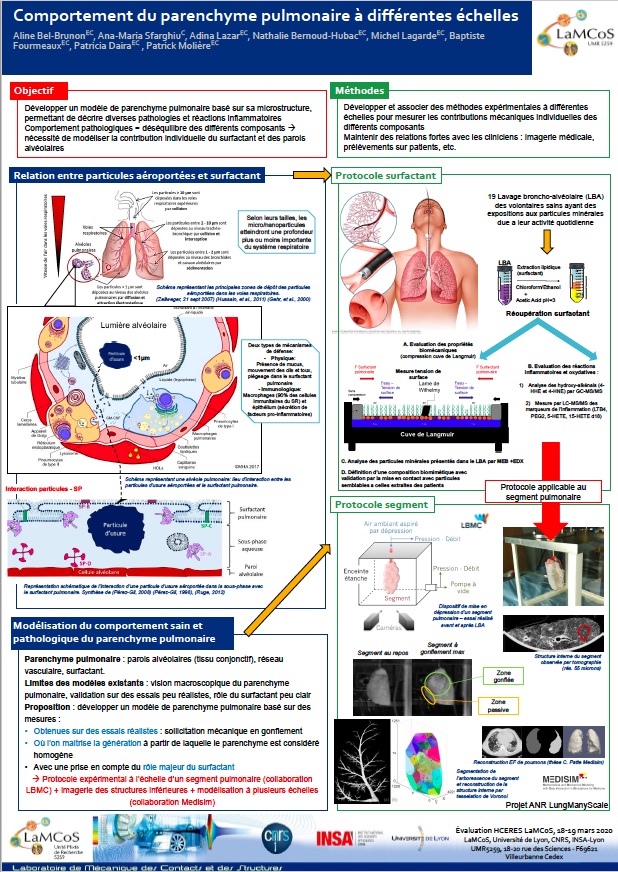
Présentation
La plate-forme biomécanique du LaMCoS, UMR5259 INSA Lyon CNRS, propose une expertise et une assistance dans le domaine de l’évaluation biomécanique des tissus biologiques et différents dispositifs médicaux de la communauté scientifique publique et privée. Elle est ouverte à tout type de projets biomécaniques en collaboration ou contractualisés.
Différents types de services sont proposés :
- Conseils et accompagnements dans la mise en place de projets en biomécanique
- Formation théorique et pratique en biomécanique
- Réalisation des essais mécaniques sur différents types de tissu/structures biologique ou biomimétique et a différentes èches (du lubrifiant aux tissus durs) ; dans divers contextes physiologiques et physiopathologiques ; correlation avec des predictions in silico
- Evaluation des mécanismes de frottement et d’usure des dispositifs médicaux
- Collecte et analyse des particules de dégradation des matériaux (ex. : les particules d’usure)
- Evaluations des interactions mécano-biologiques tissulaires (tissus issus des protocoles cliniques animaux ou humains) ou cellulaires (lignées cellulaires ou cultures primaires) à l’interface tissus / implant
- Synthèse de différents types de lubrifiants biomimétiques à base des lipides
- Veille technologique
Compétences
- Conceptions et adaptations des simulateurs expérimentaux pour la caractérisation de différents types de tissu/structures biologiques
ou biomimétiques
- Caractérisations mécaniques de différents types de tissu/structures biologique ou biomimétique
- Caractérisations bio-tribologiques de différents types d’implants articulaires
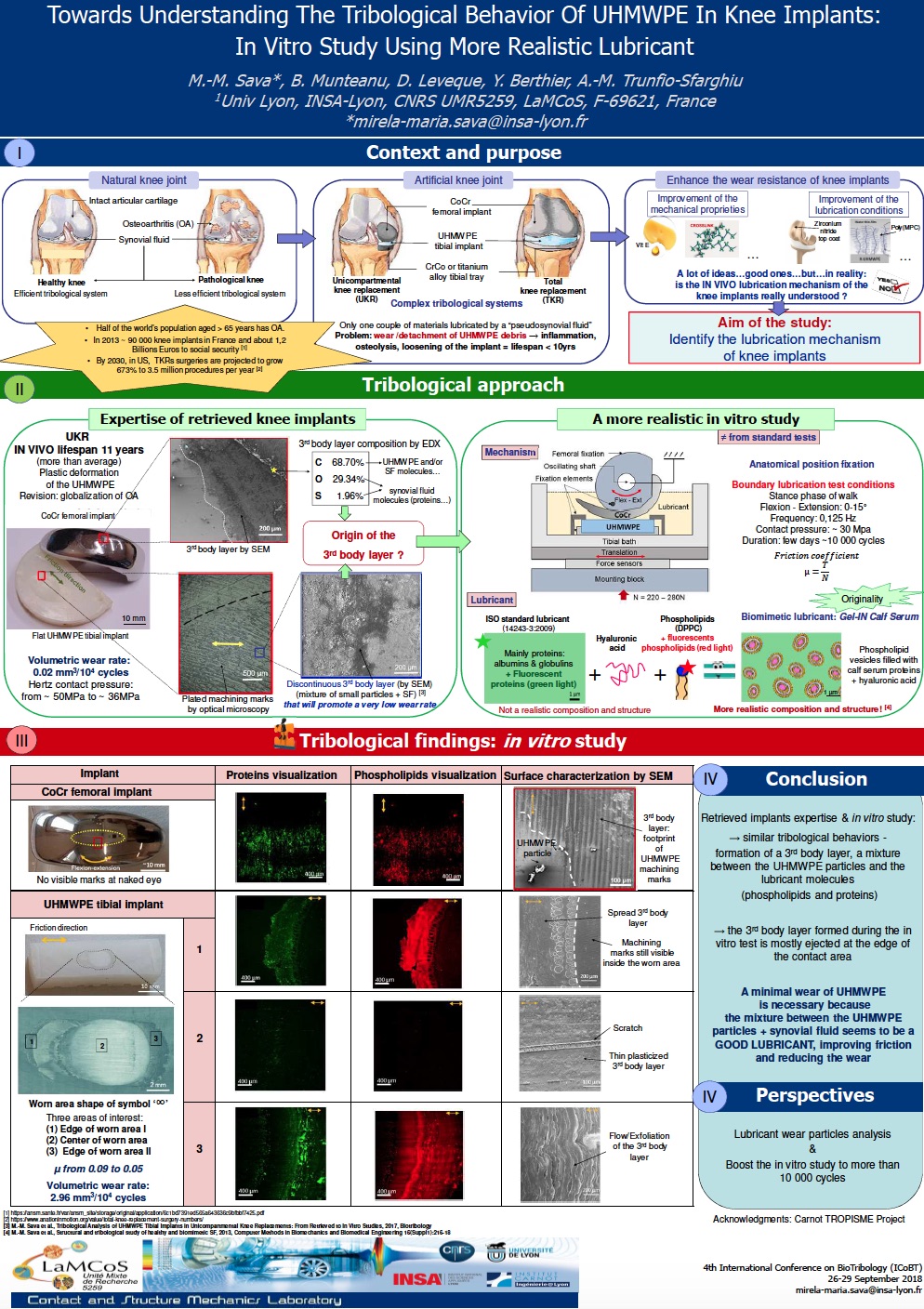
- Caractérisations de l’usure des implants après différents tests de simulateur ainsi qu’a des explants (usure volumique des corps en contacts, état des surfaces, analyse des particules d’usure dans les lubrifiants, analyse des marqueurs lipidiques pro-inflammatoires dans le lubrifiant)
- Analyse des particules d’usure générées par les différents dispositifs médicaux et etude de leurs impact biologiques
in situ (dans des tissus péri-protéiques après protocole cliniques
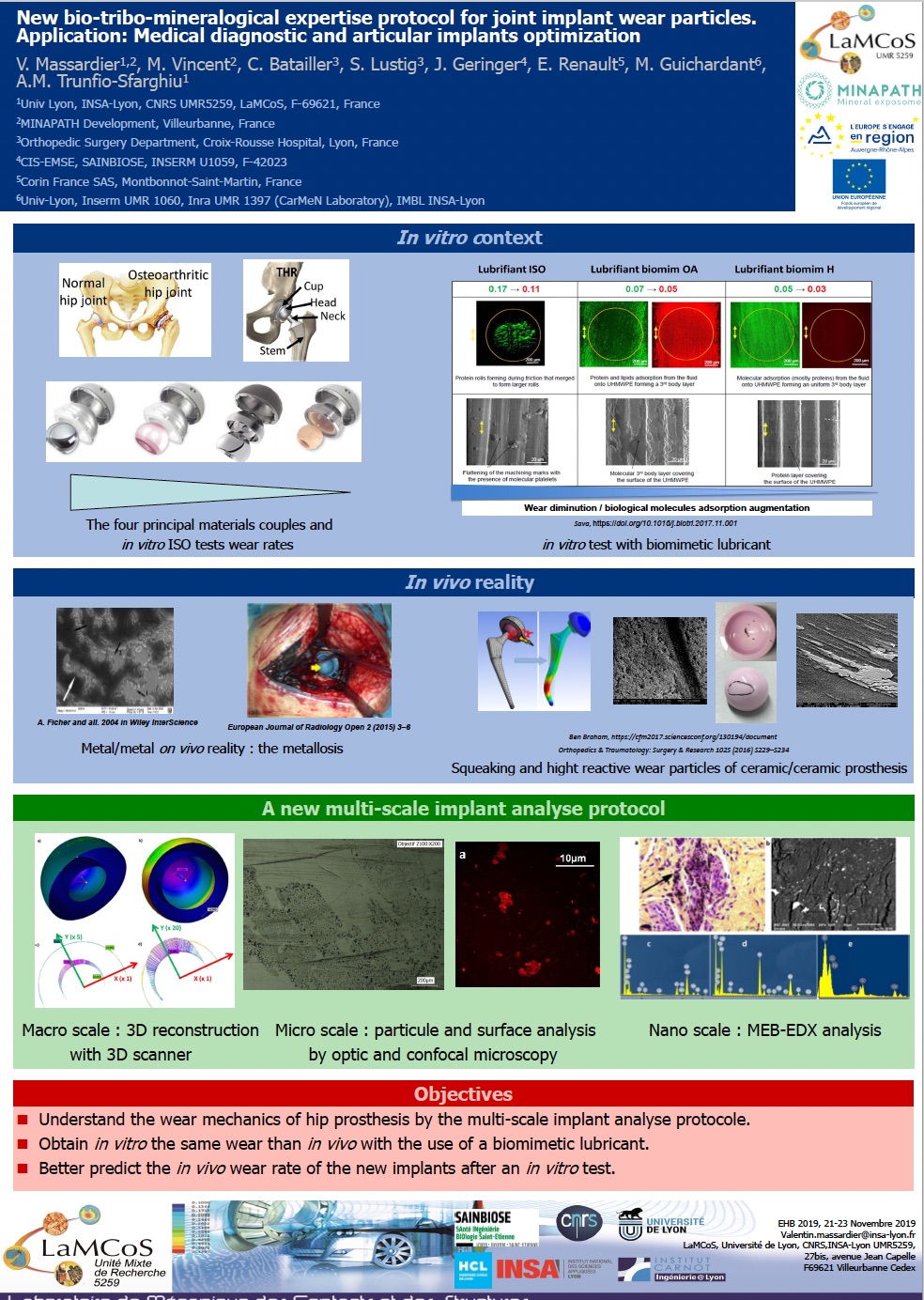
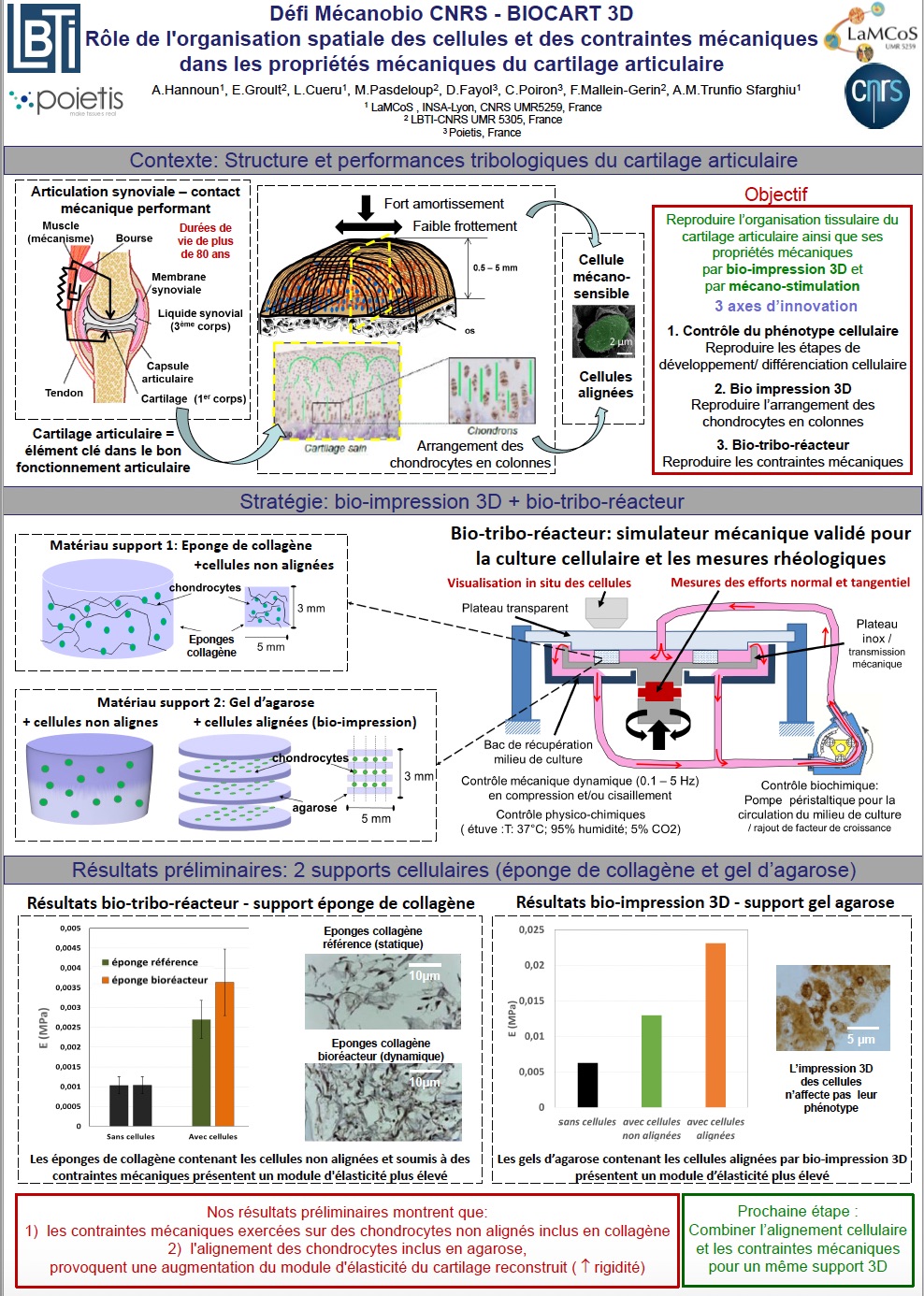
et/ou pendant les tests bio-tribologiques ) - Optimisation de l’interface tissus biologique / implant en optimisant la réaction mécano-biologiques à cette interface via des bio-tribo-réacteurs
- Synthèse des lubrifiants biomimétiques du liquide synovial
Equipements
-
4 salles L2 et une salle ISO5 disponibles pour la préparation des tissus biologiques et pour des tests in vitro
Elles sont équipées avec des PSMs, incubateurs, centrifuges, autoclaves, perceuse, scies, microtome, microscopie optique), essais biomécaniques sur tissus vivants, extraction et tri des particules.
Lignes cellulaires existantes : neuroblastomes SH-SY5Y, macrophages RAW
Cultures primaires humaines à partir des protocoles cliniques existants : chondrocytes, synoviocytes
Des techniques supplémentaires sont aussi disponibles tels que la microscopie à fluorescence, la spectroscopie UV-visible, l’électrophorèse et l’histochimie.
Des outils plus spécifiques permettent l’évaluation des propriétés mécaniques des matériaux ou des bio-systèmes (ex-vito, in vitro ou des systèmes model) ainsi que leur interaction …


La salle ISO5 a été équipée pour l'expertise bio-tribologiques des explants grâce au projet FEDER/Région/CNRS: Bio-tribo-mineralogie
- Machine de traction
-
Rhéomètre ARES
Rhéomètre à déformation contrôlée
Technologie SMT (moteur et transducteur séparés)
Plage de mesure du couple : 0.02 à 2000 g • cm
Plage de mesure de force normale : 2 à 2000 gmf
Fréquence de fonctionnement maximale : 100 rad/s
Géométries disponibles : plaques parallèles en acier inoxydable ou verre (50 mm), cône et plaque ; possibilité d’immersion totale de l’échantillon
Modes de test possibles :- Méthodes de test dynamiques (par exemple : balayage de déformation, balayage de fréquence, balayage de temps)
- Méthodes d’essai stables et transitoires (par exemple : balayage de vitesse, relaxation des contraintes, boucle thixotrope)

-
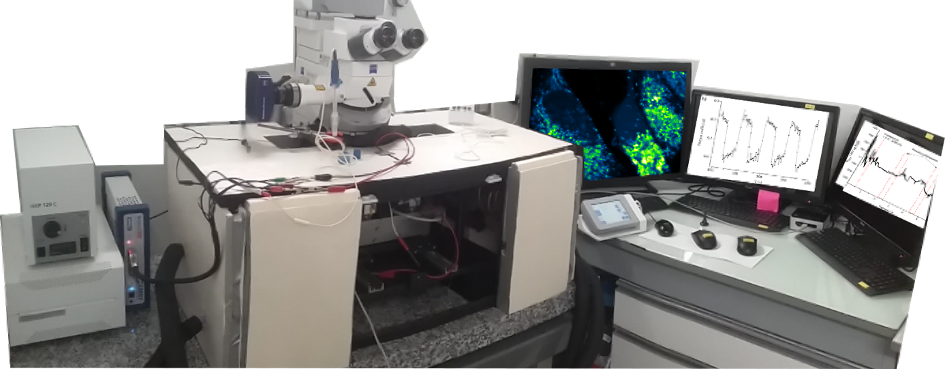
Microscope Zeiss Axio à tête confocale type LSM700
Configuration du microscope permettant la visualisation d’un contact frottant (compatible avec le bio-tribometre ci-dessous) ou des cellules (tissus) soumises à des contraintes mécaniques (compatible avec bio-reacteur ci-dessous) en microscopie optique classique, fluorescence et/ou microscopie confocale.
Dans sa configuration actuelle, l'utilisateur dispose d'une excitation à 405 nm, 488 nm, 555 nm ou 639 nm et du logiciel Zeiss ZEN équipé avec les modules spécifique pour pouvoir faire du :- FRAP (Fluorescence Recovery after Photobleaching)
- FRET (Förster resonance energy transfer)
- RICM (Reflection inteference contrast microscopy)

- Système micropipette
-
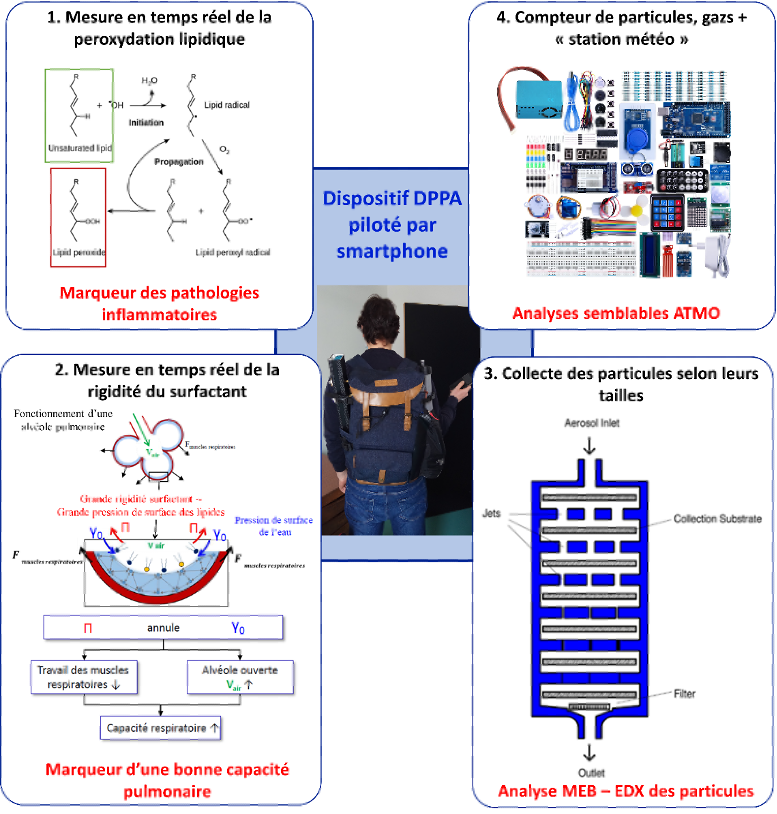
Système de collecte et analyse des particules aéroportées sur surfactant biomimétique
Ce système portatif avec une autonomie de 4h comporte
- 1) Une partie collecte de l’air (particules et gazes) sur surfactant biomimétique et mesures en temps réel du stress oxydatif (marqueur d’un processus inflammation) et de la rigidité alvéolaire (marqueur d’un processus pathologique dégénératif)
- 2) Une partie permettant les mesures en temps réel des paramètres atmosphériques (pression, température, humidité, concentration gaz, compteur des particules)
- 3) Une partie collecte des particules sur des supports compatibles avec les analyses MEB-EDX
-
Bio-tribomètre
Simulateur permettant de solliciter simultanément en compression, cisaillement et roulement des tissus biologiques, des matériaux mous simulant les tissus biologiques ou des implants articulaires (adaptable en configuration de simulateur de la prothèse unicompartimentale du genou ou de la hémi prothèse de l’épaule). Ce bio-tribometre a été conçu afin de permettre d’étudier à grande résolution les mécanismes de la bio-lubrification par multicouches lipidiques (https://anr.fr/Project-ANR-12-BS04-0008). Il est compatible actuellement avec la microscopie confocale à fluorescence et les cultures cellulaires.
Caractéristiques techniques :- Chargement normal maximal : 300N
- Mouvement horizontal : course maximale 12mm, fréquence maximale 100 Hz
- Mouvement vertical grand débattement : course maximale 30mm, faible vitesse (qq mm/s)
- Mouvement vertical petits débattement : course maximale 80µm, fréquence maximale 100Hz
- Mouvement de rotation : faible vitesse (qq mm / s en fonction de la configuration) ; couple maximal 30 N*m
- Possibilité de synchroniser les mouvements suivant une courbe prédéfinie (cycle de marche)
- Plusieurs types de capteurs pour la mesure dynamique des efforts, couples et des déplacements suivant les trois axes
- Possibilité d’adaptation des cellules électrochimiques spécifiques (collaboration équipe CORRIS MATEIS)
-
Bio-tribo-réacteur
Simulateur permettant de solliciter simultanément en compression et cisaillement 3 échantillons 'cultures cellulaires', les échantillons baignant dans une circulation de liquide nutritif en circuit fermé régulé en débit par pompe péristaltique.
Les 2 sollicitations peuvent être couplées ou être indépendantes.
-
Compression :
- Dz = 0 à 870µ avec précision de 50nm,
- Fréquence de 0 à 100 Hz, sinus, triangle.
-
Cisaillement :
- Dt = 0 à 870µ avec précision de 50 (rotation d’environ +/- 2° sur un rayon de 20 mm)
- Fréquence de 0 à 100 Hz, sinus, triangle.
-
Forces et moments applicables :
- Fz max applicable = 200 N, sensibilité 'en place' : 0,001N, précision 0,01N
- Mz max applicable= 0,4 N.m, sensibilité 'en place' : 0,001 N.m, précision 0,01 N.m.
-
Conditions de fonctionnement :
- Régulation des mouvements en boucle fermée PID Cedrat, précision 50nm.
- Logiciel avec synchronisation des mesures de Fz/Dz et Mz/Dt en autonomie plusieurs mois afin de permettre la caractérisation rhéologique en configuration normale et suivre le développement des cultures in-situ
- Enceinte compatible avec les cultures cellulaires et le microscope confocal à fluorescence

-
Compression :
-
Collaboration avec les plateformes
- de métrologie INSA
- d’imagerie CLYM
- de lipidomique

