Axe thématique : Maladies articulaires
L’arthrose (usure des cartilages articulaires) pose un problème de santé majeur car elle est asymptomatique jusqu’à un stade avancé où alors aucun traitement n’est vraiment efficace, seule reste la pose d'un implant (arthroplastie). Implant, dont la durée de vie in vivo s'avère encore très décevante par rapport à celle extrapolée à partir de simulations ex vivo et cela malgré les efforts internationaux d’optimisation des matériaux.
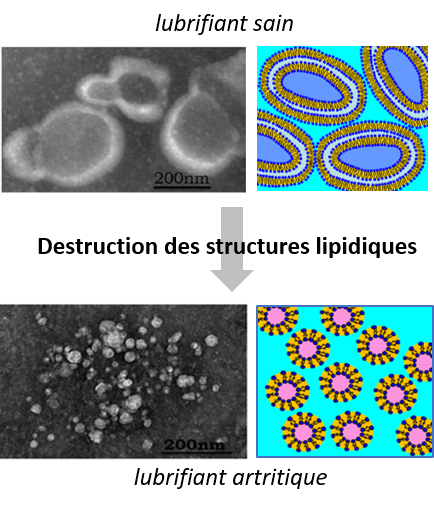
Les discordances entre les durées de vie in vivo et ex vivo sont principalement imputées aux conditions d'essais ex vivo insuffisamment réalistes vis-à-vis des particularités mécaniques et physico-chimiques des lubrifiants biologiques. Ces lubrifiants biologiques sont des milieux moléculaires complexes qui sous contraintes tribologiques créent des couches moléculaires sur les surfaces frottantes des implants articulaires modifiant ainsi leur comportement en frottement et en usure.
Dans ce contexte, nos premiers travaux communs (LAMCOS / CARMEN / ILM, thèse Constantin Ionut MATEI, 2012, et Magdanena CONRECI, 2012) ont montré que les structures moléculaires à base de phospholipides sont essentielles dans l’obtention d’un faible coefficient de frottement et une faible usure d’une articulation saine. Par conséquent, le premier objectif de cet axe est d’identifier les structures phospholipidiques ayant un rôle clé dans l’évolution de l’arthrose afin de les utiliser comme marqueurs précoces dans le diagnostic.
Ceci permettra ensuite, dans un deuxième objectif, de maîtriser les interactions mécaniques et physicochimiques de ces assemblages moléculaires avec les surfaces des implants articulaires et les tissus adjacents (os / cartilage) afin d’estimer de manière réaliste la durée de vie des implants et de concevoir des solutions thérapeutiques moins handicapantes qu’une arthroplastie totale.
Des modèles numériques simulant la transmission des contraintes mécaniques multi-échelles (de l’organe : articulation, à la cellule : chondrocytes / ostéocytes) permettront d’optimiser les nouvelles solutions thérapeutiques afin d’obtenir une adaptation parfaite au patient autant de point de vue mécanique que biologique (patients sportifs, dégénératifs ou inflammatoires) et garantir ainsi leur durée in vivo.
Les discordances entre les durées de vie in vivo et ex vivo sont principalement imputées aux conditions d'essais ex vivo insuffisamment réalistes vis-à-vis des particularités mécaniques et physico-chimiques des lubrifiants biologiques. Ces lubrifiants biologiques sont des milieux moléculaires complexes qui sous contraintes tribologiques créent des couches moléculaires sur les surfaces frottantes des implants articulaires modifiant ainsi leur comportement en frottement et en usure.
Dans ce contexte, nos premiers travaux communs (LAMCOS / CARMEN / ILM, thèse Constantin Ionut MATEI, 2012, et Magdanena CONRECI, 2012) ont montré que les structures moléculaires à base de phospholipides sont essentielles dans l’obtention d’un faible coefficient de frottement et une faible usure d’une articulation saine. Par conséquent, le premier objectif de cet axe est d’identifier les structures phospholipidiques ayant un rôle clé dans l’évolution de l’arthrose afin de les utiliser comme marqueurs précoces dans le diagnostic.
Ceci permettra ensuite, dans un deuxième objectif, de maîtriser les interactions mécaniques et physicochimiques de ces assemblages moléculaires avec les surfaces des implants articulaires et les tissus adjacents (os / cartilage) afin d’estimer de manière réaliste la durée de vie des implants et de concevoir des solutions thérapeutiques moins handicapantes qu’une arthroplastie totale.
Des modèles numériques simulant la transmission des contraintes mécaniques multi-échelles (de l’organe : articulation, à la cellule : chondrocytes / ostéocytes) permettront d’optimiser les nouvelles solutions thérapeutiques afin d’obtenir une adaptation parfaite au patient autant de point de vue mécanique que biologique (patients sportifs, dégénératifs ou inflammatoires) et garantir ainsi leur durée in vivo.
Contact : BERNOUD-HUBAC Nathalie, SFARGHIU Ana-Maria